Las cuatro propiedades coligativas
¿Qué es una propiedad coligativa?
En química se llaman
propiedades coligativas a aquellas propiedades de las disoluciones y sus
componentes que dependen únicamente del número de moléculas de soluto, el cual
es no volátil en relación al número de moléculas de solvente y no de su
naturaleza.
En otras palabras, quiere decir que dependen
de la concentración de las partículas disueltas, y no de que tipo de soluto es.
Ahora, tienes que saber que
existen cuatro propiedades coligativas: la primera es el descenso crioscópico,
la segunda el ascenso ebulloscópico, tercero la presión osmótica y por último
el descenso de la presión de vapor.
Veamos a que se refiere cada
una de ellas.
Descenso crioscópico
El descenso crioscópico o
depresión del punto de fusión a la disminución de la temperatura del punto de
congelación que experimenta una disolución respecto a la del disolvente puro.
Aumento ebulloscópico
El aumento o ascenso
ebulloscópico es el aumento del punto de ebullición que experimenta un
disolvente puro, al formar una disolución con un soluto determinado en un
solvente. Por ejemplo, el agua con sal, hierve a mayor temperatura que el agua
sin sal.
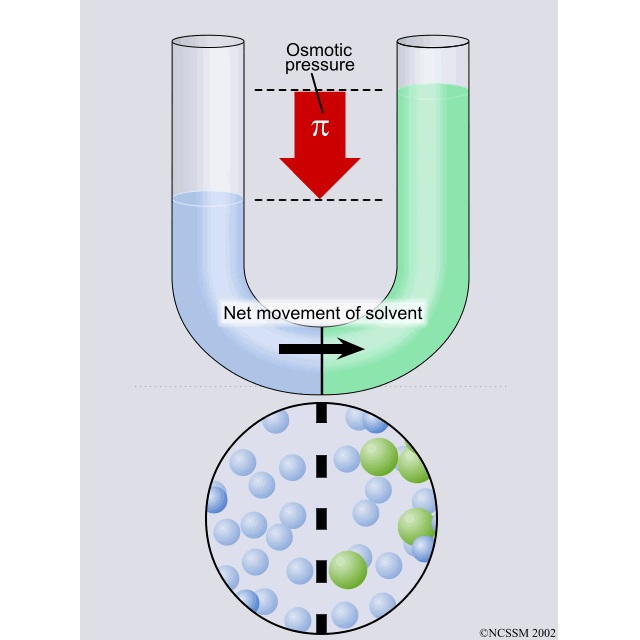
Presión osmótica
La presión osmótica puede
definirse como la presión que se debe aplicar a una solución para detener el
flujo neto de disolvente a través de una membrana semipermeable.
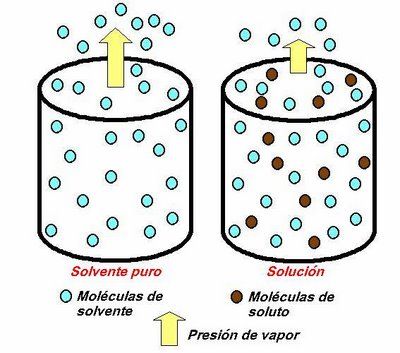
Descenso de la presión de vapor
La presión de vapor de un disolvente desciende cuando se le añade un soluto no volátil. Este efecto es el resultado de dos factores:
- La disminución del número de moléculas del disolvente en la superficie libre
- La aparición de fuerzas atractivas entre las moléculas del soluto y las moléculas del disolvente, dificultando su paso a vapor.